Afinal de contas: O que é USP 232, 233 e ICH Q3D?
USP <232>
USP => Farmacopéia Norte Americana ( United States Pharmacopeia)
<232> => O Capítulo 232 da Farmacopéia Norte Americana aborda os limites permitidos de impurezas elementares em medicamentos e seus excipientes e é intitulado: “Impurezas Elementares – Limites”.
Além de estabelecer as concentrações limite dos elementos alvo nas diversas formulações, os capítulos 232 e 233, também estabelecem quais amostras são compreendidas pela norma.
USP <233>
USP => Farmacopéia Norte Americana ( United States Pharmacopeia)
<233> => O Capítulo 233 da Farmacopéia Norte Americana aborda os procedimentos indicados para controle impurezas elementares em medicamentos e seus excipientes e é intitulado: “Impurezas Elementares – Procedimentos”.
O capítulo 233 descreve dois procedimentos analíticos para a avaliação dos níveis de impurezas metálicas em produtos farmacêuticos. Além disso, estabelece procedimentos alternativos para a validação de outros procedimentos.
ICH Q3D
ICH => Conselho Internacional de Harmonização dos Requisitos Técnicos para Medicamentos para Uso Humano (The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human).
O ICH é uma organização que reúne as autoridades reguladoras e da indústria farmacêutica para discutir aspectos científicos e técnicos de registro de medicamentos. O principal objetivo do ICH é fazer recomendações no sentido de alcançar uma maior harmonização na interpretação e aplicação das diretrizes e requisitos para registro de produtos farmacêuticos técnicos, reduzindo ou eliminando a duplicação de testes realizados durante a pesquisa e desenvolvimento de novos medicamentos para uso humano.
Q3D => É o código utilizado pelo The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human, para identificar o Guia para Impurezas Elementares em sua última versão. É como se fosse um capítulo do guia do ICH.
Qual a importância da USP <232> / <233> e ICH Q3D?
Como sabemos, os produtos farmacêuticos (medicamentos) tem um grande papel na sociedade atual, para auxílio no tratamento de diversas enfermidades, tais como: inflamações, dores, câncer, desvios psicológicos, etc.
A segurança dos produtos farmacêuticos é uma grande preocupação para a saúde pública, por se tratar de um produto consumido por toda a população e durante todas as fases da vida.
A preocupação com impurezas elementares em medicamentos data de muitos anos atrás. Para se ter uma ideia, em 1905 a USP (United States Pharmacopeia) publicou pela primeira vez um capítulo referente ao tema.
O capítulo 231 da USP, intitulado: “Metais Pesados”, estabeleceu limites e verificações de conformidade de elementos como chumbo, mercúrio, bismuto, arsênio, estanho, cádmio, prata, cobre e molibdênio. Porém, tal procedimento indicava como método de análise a precipitação de cátions de elementos metálicos na forma de sais de sulfeto em solução aquosa. O resultado era obtido por comparação visual entre amostra e uma solução padrão de Hg, o que nos dias atuais, com a tecnologia disponível, se tornou obsoleto.
Por conta disso, desde de meados de 2010 a USP (US Pharmacopeia) e o ICH, vem trabalhando em estudos e atualizações dos capítulos 232, 233 e Q3D, a fim de anunciar e padronizar, novas metodologias de ensaio, tendo como as principais: ICP-OES (Espectrometria de emissão ótica por plasma indutivamente acoplado) e ICP-MS (Espectrometria de massas por plasma indutivamente acoplado), para a determinação de Cd, Pb, As, Hg, Ir, Os, Pd, Pt, Rh, Ru, Cr, Mo, Ni, V e Cu, além de estabelecer procedimentos de análise e validação destas metodologias.
Ok, mas qual a importância de controlar estas impurezas?
Para se ter uma ideia dos danos que estas impurezas podem causar ao organismo humano, vejamos como o exemplo a classificação destas substâncias em acordo com ICH, que classificou os elementos em grupos de acordo com sua toxidade:
Elementos da Classe 1:
São elementos tóxicos para seres humanos e têm uso limitado ou proibido para a fabricação de produtos farmacêuticos. Devido sua natureza, tais elementos devem ser avaliados em todas as fontes potenciais de contaminação. Fazem parte desse grupo: As, Cd, Hg e Pb.
Elementos da Classe 2:
São elementos tóxicos aos seres humanos dependendo da rota de exposição.
Os Elementos da Classe 2, são divididos em dois subgrupos:
Elementos de classe 2A:
São elementos que têm probabilidade relativamente alta de ocorrência no processo de manufatura do medicamento. São eles: Co, Ni e V.
Elementos de classe 2B:
São elementos que possuem uma probabilidade menor de serem encontrados nos medicamentos, devido sua baixa abundância, por isso, podem ser excluídos da avaliação de risco caso não sejam adicionados intencionalmente ao processo. São eles: Ag. Au, Ir, Os, Pd, Pt, Rh, Ru, Se e Tl.
Elementos de classe 3:
Os elementos da Classe 3 são conhecidos pela toxicidade relativamente baixa por administração via oral, mas devem exigir maior consideração em avaliações de inalação e via parenteral. São eles: Ba, Cr, Cu, Li, Mo, Sb e Sn.
Percebem agora a importância do controle desta impurezas no processo de fabricação de medicamentos???
E pensar que quando eu era pequeno minha mãe passava
mercurocromo (C20H8Br2 HgNa2O6) em meus ralados, que aliás eram muitos!!! J
Preparo de amostras para determinação de Impurezas Elementares em produtos farmacêuticos
A digestão por microondas é uma das técnicas de digestão de amostras mais eficazes para o preparo de amostras para a determinação de impurezas elementares em produtos farmacêuticos, pois todo o processo de digestão é realizado em vazos fechados de alta pressão, o que permite a digestão completa da amostra e inibe a perda de analitos semivoláteis para o ambiente do laboratório.
A digestão consiste na decomposição de compostos orgânicos e inorgânicos em seus elementos constituintes, empregando ácidos minerais e aquecimento.
Ex.: CH2n + HNO3 + calor => CO2(g) + 2NO(g) + 2H2O
Existem no mercado dois sistemas de digestão de amostras por energia microondas.
O Digestor de Amostras por Energia Microondas para digestão em batelada:

E o sistema sequencial de digestão de amostra por energia microondas, modelo Discover SP-D:

Qual a diferença ente o método por batelada e sequencial?
No método por batelada, você pode digerir até 40 amostras numa única corrida, porém o tem de digestão pode chegar a 40 – 45 minutos, pois a energia microondas gerada pelo magnetron é dividida dentro da cavidade do digestor.
Já no sistema sequencial, toda energia de microondas gerada (300 whatts) é direcionada diretamente para a amostra, o que reduz o tempo de digestão drasticamente, para menos de 10 minutos por amostra.
Se o laboratório tiver uma rotina muito alta de amostras, indica-se o digestor por batelada.
Se o laboratório tiver uma rotina pequena ou amostras de difícil digestão, indica-se o sistema sequencial.
Identificação e Quantificação de Impurezas Elementares
Após o preparo de amostras é necessária a determinação da presença ou não do elemento de interesse e, caso esteja presente, quantificar sua presença na amostra.
A US Pharmacopeia propõe como principais métodos de quantificação os ensaios por ICP-OES ou ICP-MS.
O resultado analítico, para a aprovação da liberação do lote do medicamento, deve estar em acordo com os “Limites Diários de Exposição” (Permitted Daily Exposure – PDE).
Os PDEs são expressos em μg/dia, refletindo apenas exposição máxima diária permitida. A conversão para concentração permite uma maior facilidade na avaliação das impurezas elementares. Diferentes abordagens podem ser estabelecidas para isso, porém no método mais comum, assume-se uma máxima dose diária não maior do que 10 mg/dia.
Nesses casos a conversão de PDE em concentração dá-se pela fórmula:
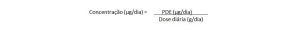
Nota: Os níveis de impurezas elementares mais elevados do que PDE estabelecidos podem ser aceitáveis em casos específicos, como dosagem intermitente, dosagem de curta duração (até 30 dias), risco de vida e doenças raras.
Para a descrição dos procedimentos de análise elementar, seja por ICP-OES ou ICP-MS, é introduzido o conceito de J, concentração do elemento de interesse no limite alvo:

onde, como dito acima, PDE é a exposição diária permitida para o elemento, MDD é máxima dose diária do medicamento e DL é o fator de diluição da amostra após o preparo da mesma.
A conformidade com a norma pode ser demonstrada por duas maneiras:
1) Opção pela análise do produto, na qual o resultado obtido a partir da análise de uma unidade de dosagem típica, dimensionado para uma dose diária máxima é comparada com a dose diária;
2) Opção pela soma, na qual o resultado é demonstrado através da soma de cada elemento em cada componente do fármaco.
Espectrometria por Emissão Óptica com Plasma Indutivamente Acoplado (ICP-OES)

ICP = Inductively Coupled Plasma + OES = Optical Emission Spectrometer
Como funciona um ICP-OES?
A técnica de ICP-OES permite medir a radiação que é emitida pelos elementos de uma amostra colocada num plasma acoplado indutivamente. Trata-se de um plasma de argônio que é produzido através da interação entre um campo de radiofrequência e gás argônio ionizado, conseguindo atingir temperaturas na ordem dos 10.000 ºK.
Após a atomização, os átomos emitem radiação que pode propagar em duas orientações:
▪ Radialmente => permite uma maior linearidade para concentrações mais elevadas para o elemento em estudo;
▪ Axialmente => diminui o sinal gerado por interferentes do plasma, concentrando mais eficazmente a radiação da amostra.
A radiação emitida passa depois para um espectrofotômetro para separar e selecionar os comprimentos de onda desejados, que serão posteriormente transmitidos ao detector.
O sinal, ou seja, a intensidade da radiação emitida, é depois comparada com padrões de concentração conhecida dos elementos em análise para determinação qualitativa e quantitativa.
Espectrometria de massas por plasma indutivamente acoplado (ICP-MS)

É um tipo de espectrometria de massa que permite detectar metais e diversos não metais em concentrações baixíssimas, através da ionização dos elementos com plasma acoplado indutivamente e a utilização de um espectrômetro de massas para separar e quantificar os íons de interesse.
O ICP-MS apresenta inúmeras vantagens em comparação ao EAA Chama, EAA Forno e ICP-OES, entre as quais, a capacidade de analisar vários elementos com limites de detecção na ordem de “ppt”, quantificar concentrações isotópicas e sua percentagem na amostra e de se hifenizar a HPLC, GC e IC, que permitem compreender melhor a forma em que elemento se encontram na amostra.
Mas como funciona um ICP-MS?
Basicamente, o plasma de argônio produz íons carregados gerados a partir dos elementos da amostra. Estes íons atravessam os cones de interface, que ligam o ICP ao espectrômetro de massa (quadrupolo ou triploquadrupolo); Em seguida, seguem por lentes iônicas, que retiram os interferentes.
No espectrômetro de massa, os íons são separados de acordo com a sua razão massa/carga e são encaminhados para o detector que através do sinal recebido determina qualitativa e quantitativamente os elementos de interesse presentes na amostra.
Considerações finais
Este artigo sobre Determinação de Impurezas Elementares em produtos farmacêuticos teve como objetivo mostrar de uma forma mais acessível:
- O que é USP 232, 233 e ICH Q3D;
- Qual a importância do controle de impurezas no processo de fabricação de medicamentos;
- Como saber se o produto final está em acordo com os requerimentos exigidos pela US Pharmacopeia e ICH;
- Quais as principais técnicas de preparo de amostra para este ensaio;
- Quais as principais técnicas analíticas para identificação e qualificação dos elementos controlados pela USP 233/233 e ICH Q3D.
Referências
▪ Garcia, Mariana Ortega – Preparo de amostras e análise elementar de produtos farmacêuticos – São Carlos: UFSCar, 2016.
▪ KRUG, F.J. Editor, Métodos de preparo de amostras, 1a edição revisada, Piracicaba, 2008.
▪ Pakkanen, Sampo – Determination of Elemental Impurities in Pharmaceutical Products using Inductively Coupled Plasma Emission Spectrometry – Master’s Thesis – University of Jyväskylä – Department of Chemistry – 2018.
▪ Zachariadis, G. A. and Sahanidou, E., Multi-element method for determination of trace elements in sunscreens by ICP-AES, J. Pharm. Biomed. Anal., 2009, 50, 342–348.
▪ Gouveia, S. T.; Silva, F. V.; Costa, L. M.; Nogueira, A. R. A. and Nóbrega, J. A., Determination of residual carbon by inductively-coupled plasma optical emission spectrometry with axial and radial view configurations, Anal. Chim. Acta, 2001, 445, 269–275.
▪ Silva, J. C. J.; Baccan, N. and Nóbrega, J. A., Analytical performance of an inductively coupled plasma optical emission spectrometry with Dual View configuration, J. Braz. Chem. Soc., 2003, 14(2), 310–315.
▪ Muller, A. L.; Oliveira, J. S.; Mello, P. A.; Muller, E. I. and Flores, E. M., Study and determination of elemental impurities by ICP-MS in active pharmaceutical ingredients using single reaction chamber digestion in compliance with USP requirements, Talanta, 2015, 136, 161–169.
▪ Complete Sample Preparation Guide for Analysis of Elemental Impurities (USP 232/233, 2232 and ICH Q3D Step 4 Guidelines by CEM Corporation
Caros colegas,
Chegamos ao final deste artigo sobre Determinação de Impurezas Elementares em produtos farmacêuticos: USP 232, 233 e ICH Q3D.
Espero que estes objetivos tenham sido alcançados.
Em caso de dúvida é só me contatar através do meu perfil do LinkedIn.
Espero que as informações contidas neste artigo lhes sejam úteis!
Forte abraço,
https://www.linkedin.com/in/gilson-siqueira/

