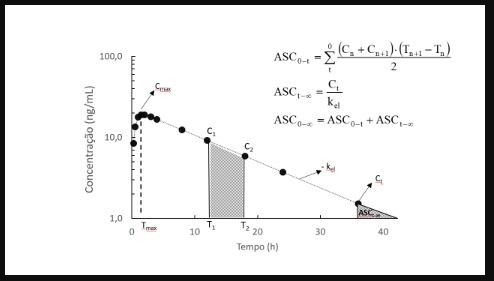
No cenário atual de desenvolvimento de dissolução nas indústrias farmacêuticas, há um erro comum em se achar que olhando um simples perfil de dissolução, pode-se prever, ou melhor, adivinhar, se será bioequivalente a um produto referencia ou não. Esta decisão pode não ser tão complexa, mas exige uma didática no desenvolvimento, envolvendo equipe multifuncional, contendo pessoas das áreas analíticas, farmacotécnicas, bioequivalência e até regulatória, que exige informações tanto in vitro como in vivo, do tipo, a condição de estudo (jejum ou alimentado), Tmax, diferença de formulação entre teste e referencia, parâmetros de dissolução, pH biorrelvante, meios biorelevantes, etc…..
Mediante todas estas informações, pode-se desenhar melhor a previsibilidade do comportamento da formulação in vivo, mas que isso, não seja uma garantia de sucesso, já que fatores in vivo não são previsíveis, e uma diferença significativa em apenas um voluntário, coloca todo o trabalho a perder.
Normalmente, quando falamos de estudos em jejum para formas de liberação imediata por exemplo, avaliamos os meios HCl 0,1N e no TP 4,5, além dos meios biorelevantes FASSIF (simulado fluido intestinal em jejum) e/ou FASSGF (simulado fluido gastrico em jejum). Agora, quando o estudo será conduzido na condição alimentado, recomenda-se os meios que contemplam o pH 3 a 7 que seria o pH estomacal nesta condição. Com isso, um perfil de dissolução nos meios TP 4,5 e 6,8 podem ajudar na avaliação e os meios biorelevantes FESSIF e FESSGF (fluidos simulados do intestino e estomago em alimentado).
Prever um resultado in vivo com base nos perfis de dissolução in vitro, não é correlação, mas sim, adivinhação. Porém, não há necessidade de se obter sempre uma Bio negativa para se fazer a correlação, e então, ter o sucesso no segundo estudo. Um bom trabalho multidisciplinar, um bom método de dissolução e um protocolo de estudo in vivo adequado, aumentam as chances do sucesso.
Lembrem que não existe mágica na dissolução, mas sim disciplina….
Autor:
Gamal Ali Moussa – Consultor na empresa Dissam
Contato: dissam2015@gmail.com
Tel.: 11-997653916

Referências sobre o assunto:
CP 476/2018 – Anvisa
Proposta de revisão do capítulo nº 10 da Farmacopeia Brasileira, Equivalência Farmacêutica e Bioequivalência de Medicamentos
http://portal.anvisa.gov.br/consultas-publicas#/visualizar/369230
http://portal.anvisa.gov.br/documents/10181/3961681/CONSULTA+P%C3%9ABLICA+N%C2%BA+476+COFAR.pdf/b60c93a3-f53c-4701-9dbb-65a90aacb1bc
Legislação Anvisa
http://portal.anvisa.gov.br/registros-e-autorizacoes/medicamentos/produtos/bioequivalencia-e-biodisponibilidade/legislacao
Trabalhos Publicados Anvisa
http://portal.anvisa.gov.br/registros-e-autorizacoes/medicamentos/produtos/bioequivalencia-e-biodisponibilidade/trabalhos-publicados
Guideline for Bioequivalence Studies of Generic Products
http://www.nihs.go.jp/drug/be-guide(e)/Generic/GL-E_120229_BE.pdf
Guidelines for bioavailability & bioequivalence studies – CDSCO
http://www.cdsco.nic.in/html/BE%20Guidelines%20Draft%20Ver10%20March%2016,%2005.pdf
Bioavailability and Bioequivalence – Canada
https://www.canada.ca/en/health-canada/services/drugs-health-products/drug-products/applications-submissions/guidance-documents/bioavailability-bioequivalence.html
GUIDELINES ON DRUG BIOEQUIVALENCE REQUIREMENTS IN THE GCC COUNTRIES – ICH
http://www.ich.org/fileadmin/Public_Web_Site/ABOUT_ICH/Organisation/GCC/Topics_under_Harmonisation/Bioequivalence.pdf
M9 – Biopharmaceutics Classification System-based Biowaivers – ICH
https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M9/M9EWG_DraftGuideline_Step2_2018_0606.pdf
Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage forms Based on a Biopharmaceutics Classification System – FDA
https://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070246.pdf